细胞外囊泡及外泌体治疗药物的临床转化与商业化指南
来源:
|
作者:石棉网&氧氖钙
|
发布时间: 2023-10-12
|
7848 次浏览
|
分享到:
EVs可以作为各种疾病的生物标志物和治疗药物,还可以作为药物和其他治疗药物的载体。随着对可扩展EVs产品的需求不断增加,以及标准细胞培养技术的发展,EVs分离和表征公司也在蓬勃发展。
细胞外囊泡(EVs)是一种由细胞释放的不具复制能力的双层脂质颗粒。EVs一般分为两大类,微泡 (ectosomes) 和外泌体 (exosomes),微泡是由质膜直接向外萌发产生的囊泡,包括直径在50 nm~1 mm之间的微泡、凋亡体、迁移体和其他大的囊泡。而外泌体是源自内涵体,直径在40~160 nm之间。然而,*近的一项研究通过追踪外泌体生物标记物挑战了这一区分理论,质膜来源和内涵体来源之间的边界更加模糊。在这些EVs中,外泌体已被广泛研究,并通常由经典的四次跨膜蛋白如CD9、CD63和CD81来表征。但不同的外泌体组不能由一套单一的生物标志物来定义,需要用综合的方法来表征。
EVs在细胞间通讯和疾病发展中起着重要作用,人们对其在疾病发展和潜在治疗中的作用的了解也日益加深,诊断和治疗应用中的EVs的全球市场正在呈指数级增长。预计全球外泌体诊断市场将从2021年的57.1 M美元增长到2026年的321.9 M美元,而外泌体治疗市场预计将从2021年的33.1 M美元增长到2026年的169.2 M美元。尽管我们已经看到EVs生物学及其应用领域取得了重大进展,但这些颗粒的能力尚未被充分利用,用于任何潜在的商业用途。EVs的分析和生产需要标准化,以便临床应用。然而,到目前为止临床应用的EV相关产品的分离方法和释放标准尚未达成共识。

EVs作为治疗药物
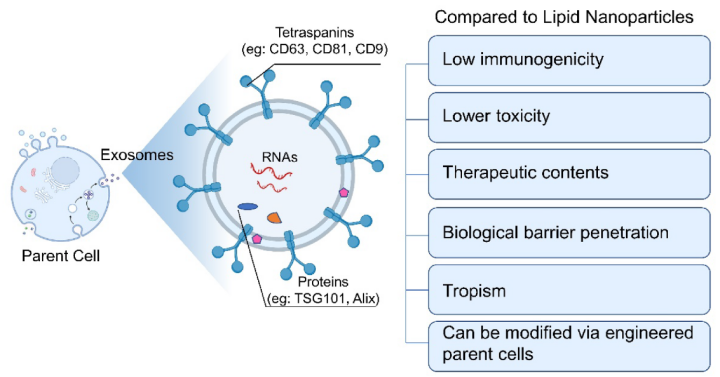
EVs天然携带着母细胞的特定因子和核酸小分子。这一特征在再生医学中得到了广泛的应用。广泛使用的间充质干细胞 (MSCs) 来源的外泌体含有干细胞的生物活性分子,因此继承了其母细胞的多能性和自我更新特性。此外,一些具有组织特异趋向性的外泌体在原属组织和器官具有一定靶向优势。例如,肺球形细胞(LSCs)来源的外泌体被应用于治疗特发性肺纤维化 (IPF)。美国FDA于2018年批准了由Alnylam制药公司开发的脂质纳米颗粒(LNPs),用于递送小干扰RNA (SiRNA),以治疗遗传性甲状腺激素淀粉样变性 (NDA 210922),标志着纳米药物输送系统向前迈出了一大步。*近,Moderna和Pfizer也在开发新冠肺炎疫苗中使用LNPs。然而,剂量依赖毒性和低效靶向递送仍是目前药物递送载体的一大局限性。仍然需要更有效、更安全的药物载体。而EVs是一种潜在的解决方案,与人工合成的脂质纳米粒相比,天然的双层磷脂具有更低的免疫原性和毒性。图1. 外泌体的特征与功能
复杂的结构对EVs来说是一把双刃剑(如图1)。一方面,EV携带天然的治疗内容物和来自亲本细胞的靶向蛋白。来自特定细胞的EVs可以跨越不同的生物屏障,如血脑屏障和气血屏障。此外,EVs的修饰可以通过改造母细胞来实现。而另一方面,EVs的异质性使得提纯过程和释放标准很难标准化。在这方面,FDA需要确信,这种异质性是EV固有的生物学特征,具有潜在的优势,并非真正需要在治疗产品中克服。在EV工程化的公司中,EV已被用于运送蛋白质、反义寡核苷酸(ASO)、微小RNA (MiRNA)、小干扰RNA (SiRNA)和信使RNA (mRNAs)。一般说来,EVs的工程化方法:(1) 修饰产生外泌体的宿主细胞;(2) 将货物装载到外泌体产生细胞中;(3) 外泌体纯化后装载货物。EVs的复杂性和异构性为临床级EVs产品的发展提供了新的机遇。生产的标准化和强有力的质量控制必须满足食品和药物管理局的所有要求和期望。我们相信,EVs研究的演变及其严格的量产将在不久的将来开启EVs产品的新纪元。对EVs作为诊断和疾病监测生物标志物的研究热点早在十年前就开始了。 EVs支持在临床应用中,作为疾病发展的液体活检。首先,EVS存在于几乎所有的生物液体中,如血液、尿液、唾液、支气管肺泡灌洗液 (BALF) 和腹水,可用于液体活组织检查。EVs由于其脂质双层膜而相对稳定,从而收集的生物样本可以在4 °C保存数天,在20 °C或80 °C保存更长时间。第三,EVs作为生物标记物,与其他无细胞成分的化合物相比,有更高的准确性,更能代表母细胞。第四,可以根据其携带的特定标记蛋白或母细胞标记物进行分离和浓缩,具有更高的灵敏度。为了应对不断增加的EVs相关研究,一些公司已经开始为研究人员提供定制解决方案,以受益并加快研发进程。专注于外泌体诊断的公司开发用于多种生物体液的EV分离试剂盒,并结合下游生物标记物检测,如RNA测序和免疫分析。为了协助基于EVs的临床试验,有一些公司专注于制造过程,为可扩展的治疗和临床试验提供GMP级别的产品。全程服务包括细胞培养、EV分离纯化、EV表征和量化。Kimera exosome®生产出**药用级别的MSC exosome产品,满足美国FDA治疗继新冠肺炎之后的急性呼吸窘迫综合征 (ARDS) 的要求。
EV来源
天然外泌体是由细胞自然产生的未经修饰的外泌体。外泌体表面特性和装载物反映了它们的起源细胞。例如,MSCs来源的外泌体具有其母细胞固有的再生和抗炎活性。肺球形细胞 (LSCs)来源的外泌体已被证明可以改善肺纤维化等呼吸系统疾病。神经干细胞 (NSCs)来源的外泌体有望满足神经保护或再生治疗的需求。具有组织特异性来源的EV也被用作初始的外泌体。来自血小板的EVs在过量出血期间提供了促进止血的支持。来自树突状细胞 (DCs) 的EVs注射到肿瘤部位可以诱导初级和次级免疫反应从而抑制甚至根除肿瘤。来自组织特定细胞的工程化外泌体可以被修饰来发挥原位作用。来自脑内皮细胞的EV可以有效地将药物跨过血脑屏障 (BBB) 输送到大脑,使其成为治疗脑癌的一种有前景的方法。携带紫杉醇的巨噬细胞来源的EV被检测到优先在癌细胞中蓄积;T细胞和CAR T细胞来源的EV可以作为替代治疗,因为它们与其母细胞相比可以避免细胞因子释放综合征和神经毒性;此外,来自肿瘤细胞的EV,如白血病细胞、乳腺癌细胞、肺癌细胞、肺癌细胞等具有肿瘤部位的特性。然而,由于其潜在的有害作用,肿瘤EVs不能用于药物输送。EVs由癌细胞(脑、骨、肝、肺等)分泌。EVs携带各种分子效应物,如miRNA,并在重塑转移部位以帮助癌细胞定植方面发挥作用。、还有报道称,EV表面的一系列整合素可能会影响EV的特异性转移。产生EV的细胞可以通过不同的培养条件和暴露在压力下(如低氧或细胞因子引入)来修饰,以产生更多或不同的外泌体。HEK293细胞系通常用于生产蛋白质,具有成熟、稳定和大规模的培养条件,也已被用于生产治疗性外泌体。293细胞在生产EV方面表现出高效率,HEK293来源的EV被认为是安全的,因此被大量用于外泌体工程。在考虑选择什么细胞来源时,应考虑EV的固有功能和目标细胞的摄取。干细胞来源的EVs可用于再生,免疫细胞用于攻击肿瘤,HEK293细胞因其安全、高产的特性则是药物递送平台的良好选择。外泌体的浓度在细胞代谢过程中会发生变化(如图2)。与2D培养相比,3D培养将产生不同的蛋白质/miRNA图谱。当使用外泌体用于治疗目的时,需要考虑这一点。搅拌槽式生物反应器、旋转壁生物反应器和固定床系统的生物反应器已在很大程度上用于扩大规模。中空纤维生物反应器在EV的规模化生产中也显示出希望。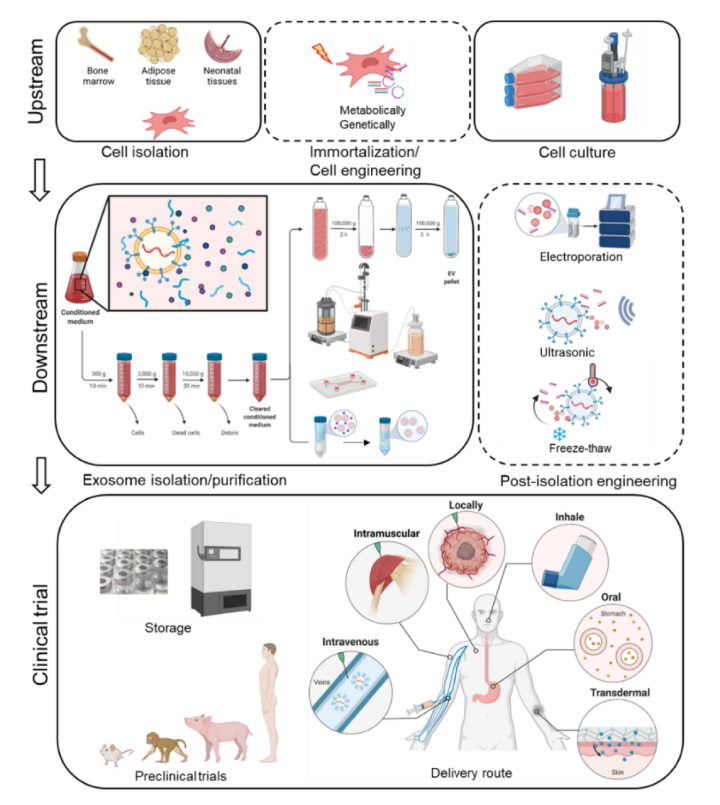
当外泌体用作治疗应用时,法规要求当中,其纯度是至关重要的参数。。FDA和世界各地的其他监管机构要求批准其纯度、效力、安全性和有效性。一个没有如肽,蛋白质,细胞外DNA和其他细胞碎片等污染物的干净产品在临床使用中是必不可少的。这对外泌体疗法尤其重要。虽然外泌体可以根据蛋白质或核酸含量来给药,但目前的标准是根据外泌体的数量(例如,1×1010)来给药。如果外来纳米颗粒作为污染物存在,剂量可能包含外泌体和非外泌体的其他纳米颗粒的混合物。超速离心法的分离效率较低(10∼25%)且耗时。切向流过滤 (TFF) 具有高效、灵活、可扩展等优点,在工业上得到了广泛的应用。外泌体亚型对于研究、诊断生物标记物的识别和治疗学的发展至关重要。然而,大小不能作为区分外泌体与其他囊泡和外泌体亚型的**标准。TFF允许类似大小的污染物与外泌体一起流动,例如其他EV类型和非囊泡颗粒。TFF可以与其他技术结合使用,如免疫捕获、密度梯度离心、离子交换层析和各种原理的微流控系统,这是目前EV分离的趋势。免疫捕获可以捕捉具有特定表面蛋白的EV;因此,由于没有广泛接受的EV标记,只有EV亚型根据所使用的抗体进行富集。这种方法可以生产出纯度高、一致性好的外泌体,但难以规模化。微流控在生产纯化的外泌体方面也有很大的前景。然而,目前缺乏方法验证和标准化的缺乏限制了微流控技术在外泌体中的应用。考虑到EVS的生物活性成分 (蛋白质/RNA) 的不稳定性,存储条件的标准化至关重要。冻融前后的形态变化不足以证明EVs的稳定性。EVs的生物学特性也需要测试。在几项研究中仔细讨论了缓冲条件和储存温度,结果推荐80 °C用于长期储存。在PBS中添加HEPES、白蛋白和海藻糖可以显著改善EV冷冻后的浓度、形态、蛋白质和核酸含量的保持,不会改变EV在体内的分布。此外,EV冻干产品因易于储存和运输而具有商业价值,并已在新冠肺炎疫苗研究中试用。目前,EV产品的浓度通常以EV颗粒的数量来衡量,EV产品的稠度取决于EV的粒度分布,而纯度取决于每微克蛋白质的颗粒数(particles/µg)。然而,对于颗粒大小和浓度的测量,不同方法的结果可能有很大差异。使用电子显微镜成像 (TEM/Cryo-EM) 和人工测量被认为是测量颗粒直径的金标准。但它不能提供颗粒浓度的**量化,而且主观和繁琐。纳米颗粒跟踪分析 (NTA) 通常用于同时测量颗粒的粒度分布和浓度,但两大主要制造商的**度与重复性方面差异巨大。电阻脉冲感应 (RPS) 是近些年新兴的对单个颗粒逐一表征的技术,不但可以同时检测外泌体尺寸和浓度,并且可以通过表面电位监测评价生物颗粒的稳定性,在EVs大小分布的精度方面分辨率更高。纳米流式,一种检测下限为40-1000 nm的流式细胞仪,可以通过多通道荧光检测器检测带有特定荧光标记的EV,同时测量EV的粒度分布和颗粒浓度。该方法可将定量和表征相结合。然而,这几种颗粒检测技术仍然需要更多比较和标准化。不同的公司对EVs产品有自己的标准。在考虑上述总结的纯化方法时,我们应该注意到,不同的分离方法对EV亚群有其偏好,从而导致miRNA和表面蛋白的不同组成。因为外泌体产品通常含有未知量的内容物,可能包括蛋白质、无细胞DNA、病毒和其他来源的囊泡的污染物,因此需要做大量的工作。纯化这些样本并不是一件容易的事,目前的方法需要更严格的控制才能成为批准的治疗方法。
临床前研究包括细胞实验和动物实验。目前,更多的研究人员正在使用大型动物或灵长类动物来进一步测试EVs产品的有效性和安全性。如果治疗是有希望的,研究人员可以向FDA提交研究新药 (IND) 申请。IND的应用包括成分、稳定性、药物的特性、动物实验结果、临床研究的详细大纲和临床试验团队。一旦IND获得批准,该药物就可以进入I期临床试验。目前大多数EV疗法都处于I期试验,在少数受试者身上进行测试,并增加剂量以确定任何副作用。EVs在人类身上的安全性正日益被人们所接受。需要更详细的临床方案才能启动II期临床试验,以测试EVs在更大人群中的疗效。
EVs的剂量通常基于EV的蛋白质含量或颗粒浓度。例如,静脉注射MSC-EVs,根据我们以前的研究,需要1×1012 EVs/Kg的天然 EVs和2×1010 EVS/Kg的靶向EVs。局部给药剂量可能有所不同。我们可以推断,人类全身性EV治疗可能需要大约1万亿个EVs。药代动力学研究对于阐明外泌体的生物学功能以及开发基于外泌体的治疗方法具有重要意义。外泌体大多是静脉注射的给药方式,但是相关研究中也有做过非肠道或口服给药的;外泌体也可以局部使用或合并到支架等设备中。静脉注射的EVs主要进入肝脏并被巨噬细胞吸收。例如,静脉注射后,4T1细胞来源的EVs在肺内显著积聚;以肠病毒为基础的肺部疾病疗法和疫苗通常被吸入,以实现较高的肺蓄积。FDA快速通道程序解决了一系列严重疾病和未得到满足的医疗需求。制药公司可以提交其生物许可证申请 (BLA) 或新药申请 (NDA) 的完整部分供FDA审查,而不是等待每个部分完成。治疗某些疾病的EVs疗法有可能被指定为优先审查,并有资格通过快速通道程序获得FDA的加速批准。到目前为止,还没有EVs产品被FDA批准用于治疗。FDA提供指导,告知申办方如何提供足够的CMC信息,以确保产品安全性、一致性、质量、纯度和强度(包括有效性))。此外,FDA和世界各地的其他监管机构对用于缓解、治疗、治愈或预防疾病的生物制品有具体要求。从细胞培养上清液中分离和纯化外泌体需要对质量、纯度、效价和重复性进行严格的控制。对外泌体的后续修饰需要额外的控制。外泌体的技术指标可能包括其来源细胞的规格以及其内容物。EVs的发布标准需要更多的评估和标准化。随着我们对EVs的理解和分离技术的发展,基于EVs的产品时代相信很快就会到来。以上内容参考于哥伦比亚大学程柯教授和MD Anderson癌症中心Raghu Kalluri教授合作发表在9月30日发表在细胞外囊泡专业学术期刊Extracellular Vesicle 上的综述文章“Guidelines for clinical translation and commercialization of extracellular vesicles and exosomes based therapeutics”。EVs可以作为各种疾病的生物标志物和治疗药物,还可以作为药物和其他治疗药物的载体。随着对可扩展EVs产品的需求不断增加,以及标准细胞培养技术的发展,EVs分离和表征公司也在蓬勃发展。文中作者重点介绍了目前基于EVs的公司和临床试验以及它们的技术、产品和应用,并且讨论了大规模生产的瓶颈,并概述了临床翻译的困难等。参考文献
Guidelines for clinical translation and commercialization of extracellular vesicles and exosomes based therapeutics. Extracellular Vesicle, 2023, 2:100029.